Ley de Avogadro – Concepto, Aplicación
Tomando Nota
Introducción a la Ley de Avogadro
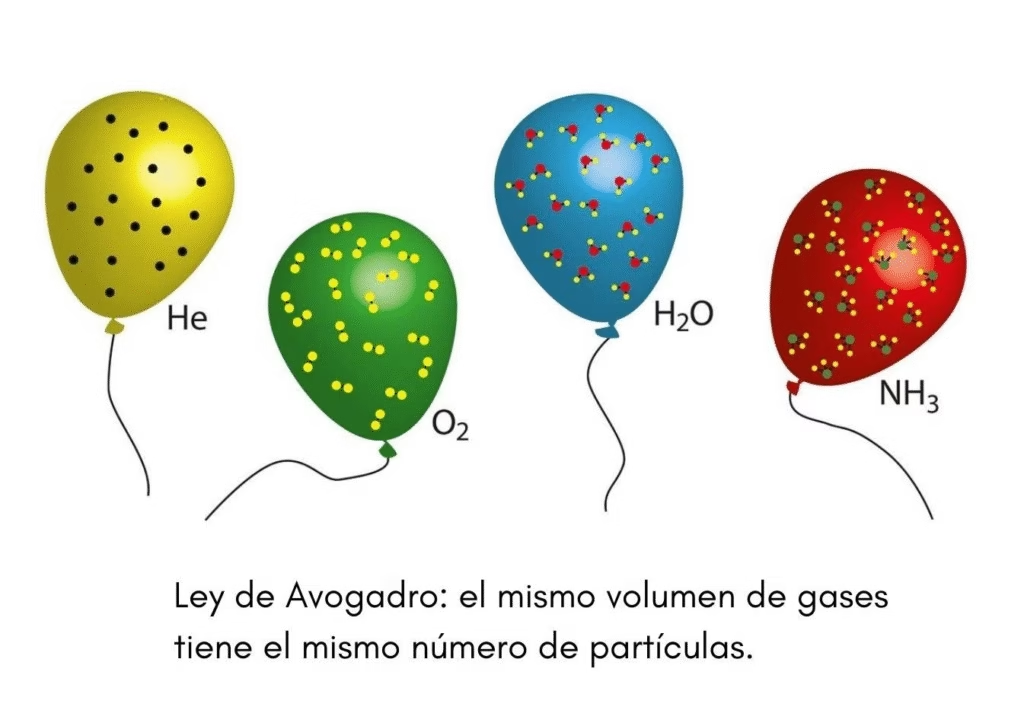
En la química, entender cómo se comportan los gases en diferentes condiciones es fundamental. La Ley de Avogadro es una de las leyes más importantes para el estudio de los gases, ya que relaciona el volumen de un gas con la cantidad de sustancia, expresada en moles.
¿Qué dice la Ley de Avogadro?
“A temperatura y presión constantes, el volumen de un gas es directamente proporcional al número de moles del gas.”
Esto significa que si se duplica la cantidad de gas (en moles), también se duplica el volumen, siempre que la temperatura y la presión no cambien.
Expresión matemática:
$$
V \propto n \quad \Rightarrow \quad \frac{V_1}{n_1} = \frac{V_2}{n_2}
$$
Donde:
- $V$ = volumen del gas (en litros, L)
- $n$ = cantidad de sustancia (en moles, mol)
- $V_1$ y $n_1$ = volumen y cantidad inicial
- $V_2$ y $n_2$ = volumen y cantidad final
¿Para qué sirve?
La Ley de Avogadro permite:
- Comparar volúmenes y cantidades de gases en reacciones químicas.
- Calcular cuánto gas se produce o se consume en una reacción.
- Entender la estequiometría gaseosa.
Ejemplo cotidiano
Situación: En una cocina, se libera gas propano de un cilindro. Si a temperatura constante se abren dos cilindros del mismo tipo al mismo tiempo, el doble de moles ocupará el doble de volumen. Esto ayuda a calcular cuánto durará el gas dependiendo del consumo.
Ejemplo resuelto
Ejercicio 1:
Un recipiente contiene 4 moles de gas ocupando 20 L. ¿Qué volumen ocuparán 6 moles del mismo gas en las mismas condiciones?
Datos:
- $n_1 = 4\ mol$
- $V_1 = 20\ L$
- $n_2 = 6\ mol$
- $V_2 = ?$
Aplicamos la fórmula:
$$
\frac{V_1}{n_1} = \frac{V_2}{n_2} \quad \Rightarrow \quad \frac{20}{4} = \frac{V_2}{6}
$$
$$
5 = \frac{V_2}{6} \quad \Rightarrow \quad V_2 = 5 \times 6 = 30\ L
$$
Respuesta: El nuevo volumen será de 30 litros.
Aplicaciones de la Ley de Avogadro
- Industria de gases medicinales: para saber cuántos litros de oxígeno se almacenan en cilindros hospitalarios.
- Estudios ambientales: para analizar gases contaminantes por mol.
- Cálculos estequiométricos: al relacionar gases en ecuaciones químicas.
- Diseño de airbags: usan la relación entre moles y volumen de gas liberado.
Actividad práctica: “Contando lo invisible con arroz”
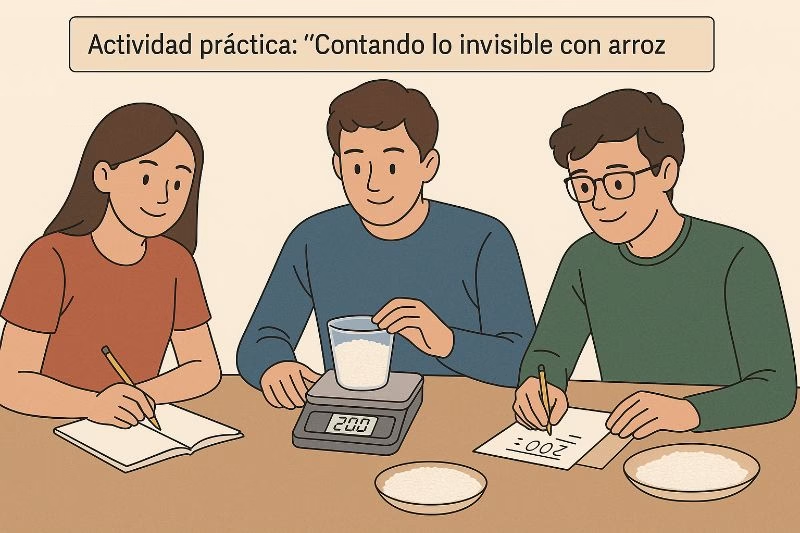
Objetivo:
Simular el concepto de mol, masa molar y la relación entre cantidad y masa a través del conteo y pesaje de objetos visibles (granos de arroz).
Materiales (por grupo):
- 1 balanza digital (gramera escolar o cocina)
- 1 recipiente pequeño (vasito, tarrito, etc.)
- Arroz crudo (cantidad libre)
- Lápiz, cuaderno y calculadora
Desarrollo paso a paso:
Fase 1: Conteo y masa promedio
- Cada grupo cuenta exactamente 100 granos de arroz y los coloca en el recipiente.
- Pesan los 100 granos en la balanza y registran el peso total en gramos.
- Calculan la masa promedio de 1 grano:
$$\text{Masa de 1 grano} = \frac{\text{masa total}}{100}$$
Fase 2: Simulación del mol
- Ahora suponen que un mol de arroz es como si tuvieran $6{,}022 \times 10^{23}$ granos.
- Pregunta: ¿Cuánto pesaría un “mol de arroz” si cada grano pesa lo que ustedes midieron?
$$\text{Masa de un mol de arroz} = \text{masa de 1 grano} \times (6{,}022 \times 10^{23})$$
Obviamente no pueden pesar eso, pero deben reflexionar sobre la magnitud.Fase 3: Aplicación práctica
- Cada grupo recibe una cantidad distinta de arroz al azar (en otro recipiente).
- Pesan su nueva muestra y calculan:
$$\text{Número de granos} \approx \frac{\text{masa medida}}{\text{masa de 1 grano}}$$
- Finalmente, estiman cuántos “moles de arroz” tienen:
$$\text{Moles} = \frac{\text{número de granos estimados}}{6{,}022 \times 10^{23}}$$
Reflexión y discusión
En tu grupo de trabajo comenta y copia
- ¿Qué tan pequeña es una partícula como un átomo comparada con un grano de arroz?
- ¿Qué tan grande es un mol en términos reales?
- ¿Por qué es útil tener una unidad como el mol en química?
Conclusión para el cuaderno
Un mol representa una cantidad muy grande de partículas. Así como podemos contar arroz por peso y estimar cuántos granos hay, los químicos cuentan átomos usando el mol y su masa molar. La Ley de Avogadro nos permite relacionar cantidad de sustancia (mol) con volumen de gas en condiciones normales.






