Ejercicios de Electronegatividad
Nivel Educativo: Décimo grado
Temas: Electronegatividad y su impacto en los tipos de enlaces químicos
Objetivo: Resolver ejercicios aplicando la electronegatividad para determinar tipos de enlaces
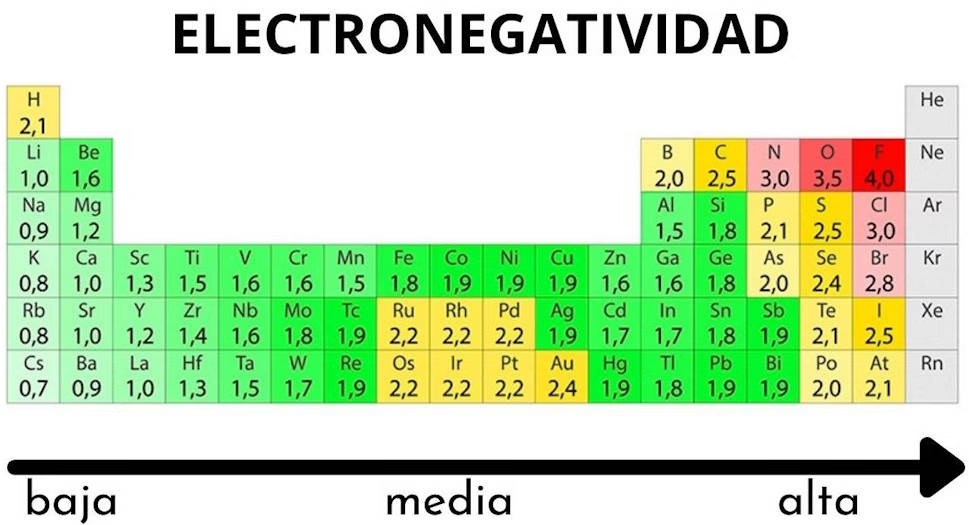
Concepto Clave: Electronegatividad y Tipo de Enlace
La electronegatividad es la capacidad de un átomo para atraer electrones en un enlace químico. La diferencia de electronegatividad (ΔEN) entre los átomos determina el tipo de enlace:
- Enlace iónico (ΔEN>1.7): Transferencia completa de electrones.
- Enlace covalente polar (0.4<ΔEN≤1.7): Compartición desigual de electrones.
- Enlace covalente no polar (ΔEN≤0.4): Compartición equitativa de electrones.
Ejercicios Resueltos para Ejemplo
Ejercicio 1: Determinación del Tipo de Enlace
Datos:
Determina el tipo de enlace para los siguientes compuestos utilizando los valores de electronegatividad:
| Elemento | Electronegatividad |
|---|---|
| Na (Sodio) | 0.93 |
| Cl (Cloro) | 3.16 |
| H (Hidrógeno) | 2.20 |
| O (Oxígeno) | 3.44 |
| C (Carbono) | 2.55 |
| F (Flúor) | 3.98 |
a) Cloruro de Sodio (NaCl)
ΔEN=∣3.16−0.93∣=2.23
Conclusión: Como ΔEN>1.7, el enlace es iónico.
b) Agua (H₂O)
ΔEN=∣3.44−2.20∣=1.24
Conclusión: Como 0.4<ΔEN≤1.7, el enlace es covalente polar.
Ejercicios para resolver
Instrucciones:
- Usa la tabla de electronegatividades proporcionada.
- Calcula la diferencia de electronegatividad (ΔEN) para cada compuesto.
- Determina si el enlace es iónico, covalente polar o covalente no polar.
Ejercicio 1: Clasificación de Enlaces
Determina el tipo de enlace en los siguientes compuestos:
- HCl (Ácido clorhídrico)
- CO₂ (Dióxido de carbono)
- KF (Fluoruro de potasio)
- NH₃ (Amoníaco)
- CH₄ (Metano)
Ejercicio 2: Relación Entre Electronegatividad y Propiedades
Explica cómo la electronegatividad afecta las propiedades de los siguientes compuestos:
- NaCl vs. H₂O: ¿Por qué uno es soluble en agua y el otro es un líquido a temperatura ambiente?
- CO₂ vs. NH₃: ¿Por qué uno es polar y el otro no?
- Metales vs. No Metales: ¿Por qué los metales tienen menor electronegatividad?
Ejercicio 3: Cálculo y Justificación
Completa la siguiente tabla con los cálculos de electronegatividad y la clasificación del enlace:
| Compuesto | Elementos | Electronegatividad 1 | Electronegatividad 2 | ΔEN | Tipo de Enlace |
|---|---|---|---|---|---|
| HCl | H – Cl | 2.20 | 3.16 | ? | ? |
| KF | K – F | 0.82 | 3.98 | ? | ? |
| CO₂ | C – O | 2.55 | 3.44 | ? | ? |
| NH₃ | N – H | 3.04 | 2.20 | ? | ? |
| CH₄ | C – H | 2.55 | 2.20 | ? | ? |
Recomendaciones para resolver los Ejercicios
- Usa una tabla de electronegatividad para los cálculos.
- Si ΔEN>1.7 el enlace es iónico.
- Si 0.4<ΔEN≤1.7 el enlace es covalente polar.
- Si ΔEN≤0.4, el enlace es covalente no polar.
- Justifica cada respuesta con base en la electronegatividad.
Trabajo y Reflexión Final
La electronegatividad es clave para entender las propiedades de los compuestos y su comportamiento químico.
Ejemplo Práctico:
- ¿Por qué el agua disuelve la sal, pero no el aceite?
- ¿Por qué algunos gases son solubles en agua y otros no?
Para la próxima clase: Investiga la relación entre el tipo de enlace y las propiedades físicas de los materiales, como dureza, solubilidad y conductividad.





