Modelos atómicos
Introducción
El modelo atómico ha evolucionado a lo largo de la historia a medida que la ciencia ha desarrollado mejores herramientas para observar el mundo microscópico. Desde las primeras ideas filosóficas hasta los modelos actuales, la representación del átomo ha cambiado significativamente, permitiéndonos comprender su estructura y su comportamiento en la materia.
A continuación, exploraremos los cinco modelos más importantes: Dalton, Thomson, Rutherford, Bohr y el modelo cuántico. Cada uno representa un paso clave en el desarrollo del conocimiento científico sobre la materia.
1. Modelo Atómico de Dalton (1803)

Contexto:
John Dalton propuso el primer modelo atómico con base científica. Inspirado por la ley de las proporciones múltiples, propuso que toda la materia está compuesta por partículas indivisibles llamadas átomos.
Postulados principales:
- La materia está compuesta por átomos indivisibles e indestructibles.
- Todos los átomos de un mismo elemento son iguales en masa y propiedades.
- Los átomos de diferentes elementos tienen propiedades distintas.
- Los compuestos se forman por combinaciones de átomos en proporciones fijas.
Importancia:
Fue el primer modelo en establecer la existencia del átomo como unidad básica de la materia.
2. Modelo Atómico de Thomson (1897)

Contexto:
Joseph John Thomson descubrió el electrón a través del experimento con tubos de rayos catódicos, lo que demostró que el átomo no era indivisible.
Características del modelo:
- El átomo es una esfera de carga positiva.
- Los electrones están incrustados en esta esfera, como “pasas en un pudín” (modelo del pudín de pasas).
- La carga positiva compensa a la negativa, haciendo el átomo neutro.
Importancia:
Fue el primer modelo en incorporar partículas subatómicas: los electrones.
3. Modelo Atómico de Rutherford (1911)
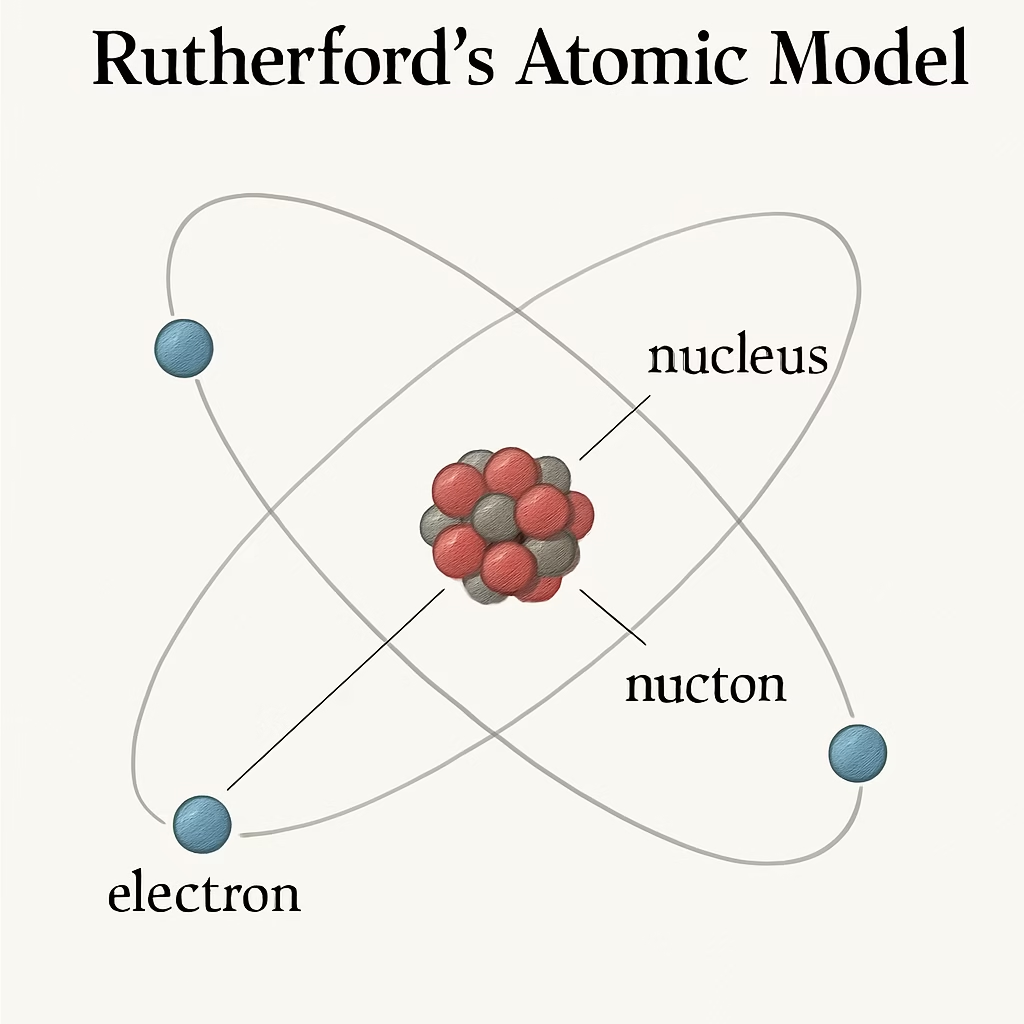
Contexto:
Ernest Rutherford realizó el experimento de la lámina de oro, en el cual observó que algunas partículas alfa atravesaban la lámina, mientras que otras se desviaban.
Principales descubrimientos:
- El átomo tiene un núcleo central, denso y con carga positiva.
- Los electrones giran alrededor del núcleo en un espacio mayoritariamente vacío.
- La masa del átomo está concentrada en el núcleo.
Importancia:
Introdujo la idea del núcleo atómico y de una estructura interna compleja.
4. Modelo Atómico de Bohr (1913)
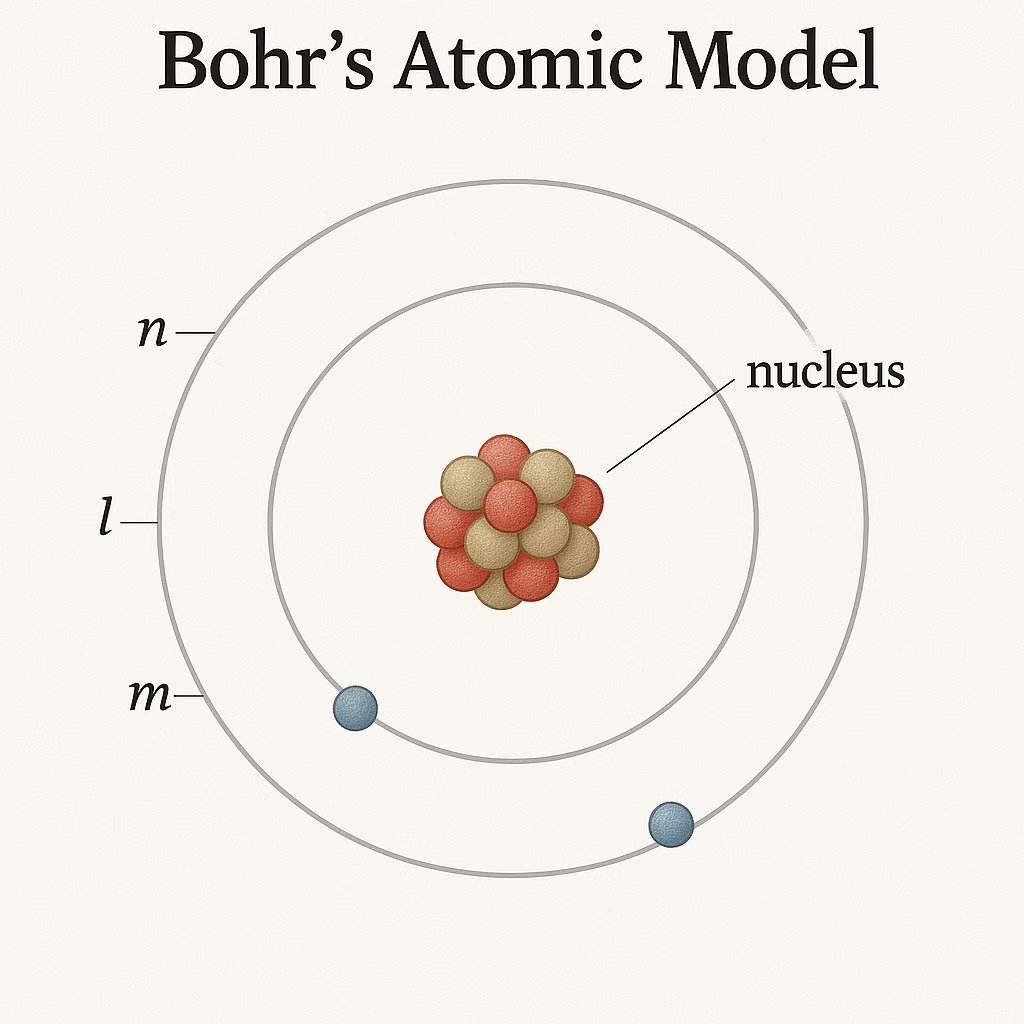
Contexto:
Niels Bohr mejoró el modelo de Rutherford introduciendo conceptos de la teoría cuántica. Su modelo explica cómo los electrones se organizan alrededor del núcleo.
Características:
- Los electrones se mueven en órbitas circulares alrededor del núcleo.
- Cada órbita tiene una energía específica.
- Cuando un electrón cambia de órbita, absorbe o emite energía en forma de luz.
Importancia:
Explica los espectros de emisión de los elementos y el comportamiento energético de los electrones.
5. Modelo Atómico Cuántico (Actual)

Contexto:
Este modelo se desarrolló gracias a los trabajos de Schrödinger, Heisenberg y otros científicos del siglo XX. Reemplaza la noción de órbitas definidas por una nube de probabilidad electrónica.
Principios clave:
- Los electrones no siguen trayectorias fijas, sino que se ubican en regiones llamadas orbitales.
- La ubicación exacta de un electrón no se puede conocer, solo su probabilidad.
- Se basa en ecuaciones matemáticas (ecuación de Schrödinger) y el principio de incertidumbre de Heisenberg.
Importancia:
Es el modelo más aceptado actualmente y sirve de base para la química moderna, la física nuclear y la computación cuántica.
Conclusión
Cada modelo atómico representó una evolución en nuestra forma de comprender la materia. A medida que la tecnología y el conocimiento avanzaron, también lo hizo nuestra capacidad para representar el átomo. Comprender esta evolución no solo nos prepara para pruebas como el ICFES, sino que nos conecta con el proceso real de construcción del conocimiento científico.






Un comentario