El mol es un puente entre lo microscópico y lo medible
Cuando estudiamos química, muchas veces hablamos de átomos, moléculas y partículas que no podemos ver a simple vista. Estas partículas son tan pequeñas que sería imposible contarlas una por una. Pero para entender cómo ocurren las reacciones químicas, necesitamos saber cuántas de esas partículas están involucradas.
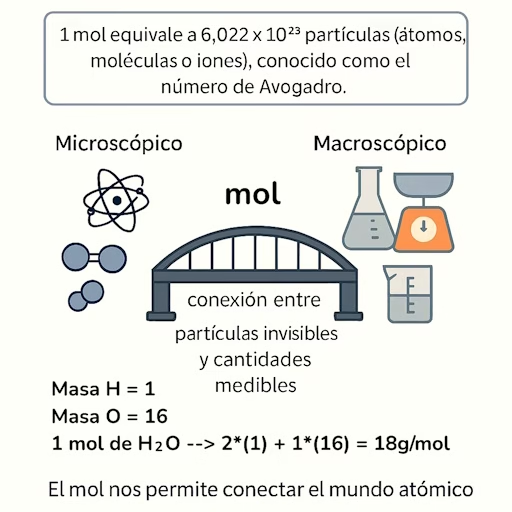
Aquí es donde entra el concepto del mol, una herramienta creada por los químicos para conectar el mundo microscópico (átomos y moléculas) con el mundo macroscópico (gramos, litros, medidas reales).
¿Qué es un mol?
Un mol es una cantidad fija de partículas.
Se define como:
$1 mol = 6{,}022 \times 10^{23}$ partículas (átomos, moléculas o iones).
Ese número se llama el número de Avogadro y es tan grande que sirve para contar átomos como si fueran docenas, pero a nivel atómico.
¿Cómo sirve como puente?
- A nivel microscópico, un mol representa una cantidad enorme de partículas.
- A nivel macroscópico, ese mol puede medirse con una balanza en gramos, o en litros si hablamos de gases.
Por ejemplo:
- 1 mol de átomos de oxígeno (O) pesa 16 gramos.
- 1 mol de moléculas de agua (H₂O) pesa 18 gramos.
- 1 mol de cualquier gas (a condiciones normales) ocupa 22,4 litros.
¿Por qué es útil?
Porque nos permite:
- Calcular cuántos gramos se necesitan para una reacción química.
- Comparar cantidades de sustancias diferentes en una misma escala.
- Hacer conversiones entre número de partículas ↔ masa ↔ volumen.
Ejemplo sencillo
Si necesitas saber cuántas moléculas hay en 18 gramos de agua:
Como 1 mol de H₂O = 18 g, y un mol tiene $6{,}022 \times 10^{23}$ moléculas,
entonces en 18 gramos de agua hay esa cantidad de moléculas, ¡aunque no puedas verlas!
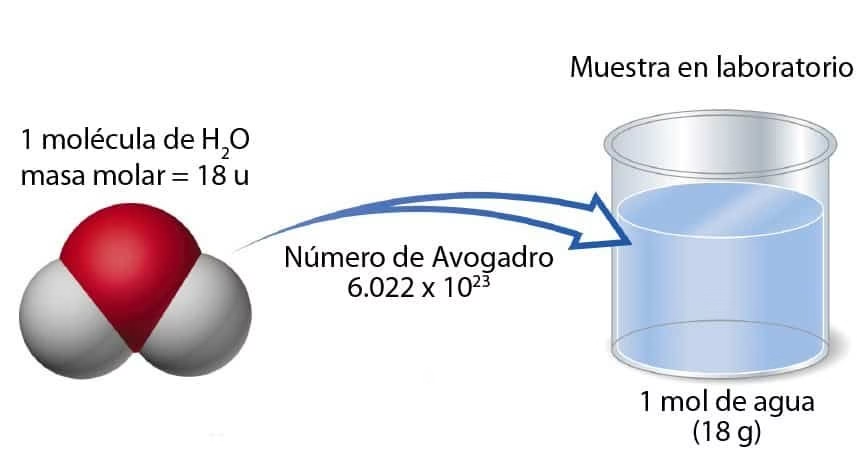
El mol es como un puente invisible que une el mundo diminuto de los átomos con lo que realmente podemos pesar, medir y observar.




Un comentario