Explorando el Átomo y la Tabla Periódica
Nivel Educativo: Décimo grado
Duración: 1 hora y 40 minutos
Temas Centrales: Modelos Atómicos, Tabla Periódica y Enlace Químico
Objetivos de la Clase
- Comprender la evolución de los modelos atómicos y su impacto en la química moderna.
- Analizar la organización de la tabla periódica y las propiedades de los elementos.
- Identificar los tipos de enlaces químicos y su influencia en las propiedades de los compuestos.
- Aplicar principios STEM en la creación de modelos atómicos y la simulación de enlaces químicos.
Materiales Necesarios
- Cartulina, plastilina, palillos o bolas de unicel para construir modelos atómicos.
- Dispositivos con acceso a internet para interactuar con simuladores de la tabla periódica.
- Tablas de electronegatividad y guías impresas sobre tipos de enlaces.
- Calculadora científica.
- Hojas de trabajo para registrar observaciones y cálculos.
Estructura de la Clase
1. Introducción: La Evolución del Modelo Atómico
Explicación Teórica:
Se presentará la evolución de los modelos atómicos, desde la teoría de Demócrito hasta el modelo cuántico moderno.
Preguntas Reflexivas:
Ahora en tu cuaderno escribe y responde:
- ¿Cómo ha cambiado la visión del átomo a lo largo del tiempo?
- ¿Por qué algunos modelos fueron descartados y otros mejorados?
- ¿Qué evidencias experimentales respaldan los modelos más recientes?
Actividad:
- Se organizarán en equipos de tres estudiantes.
- Cada equipo seleccionará un modelo atómico y lo representará con un esquema o diagrama en cartulina.
- Se discutirá la importancia del modelo seleccionado y su impacto en la ciencia actual.
2. Exploración de la Tabla Periódica y las Propiedades de los Elementos
Uso de Simuladores y Recursos Digitales:
- Se accederá a la tabla periódica.
- Cada estudiante elegirá un elemento y analizará sus propiedades: número atómico, masa atómica, grupo y periodo, electronegatividad y radio atómico.
Actividad en Equipos:
- Cada equipo elaborará una infografía en CANVA sobre un grupo específico de la tabla periódica (metales alcalinos, metales de transición, halógenos, gases nobles).
- Se incluirán datos clave y aplicaciones de los elementos en la vida cotidiana.
3. Construcción de Modelos de Enlaces Químicos
Explicación Teórica:
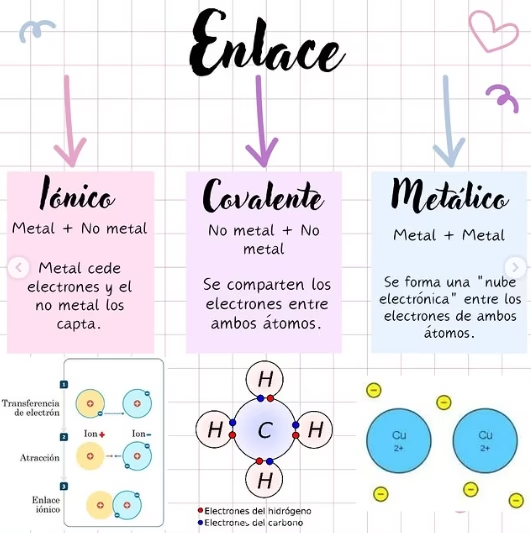
Diferencias entre enlaces iónicos, covalentes y metálicos.
Electronegatividad
Ejemplos de compuestos y cómo la electronegatividad determina el tipo de enlace.
La electronegatividad es la capacidad de un átomo para atraer electrones en un enlace químico. La diferencia de electronegatividad (ΔEN\Delta ENΔEN) entre los átomos determina el tipo de enlace:
- Enlace iónico (ΔEN>1.7) → Transferencia completa de electrones.
- Enlace covalente polar (0.4<ΔEN≤1.7) → Compartición desigual de electrones.
- Enlace covalente no polar (ΔEN≤0.4) → Compartición equitativa de electrones.
- Enlace metálico (metales) → Electrones deslocalizados en una red cristalina.
Ejemplos de Compuestos y su Tipo de Enlace
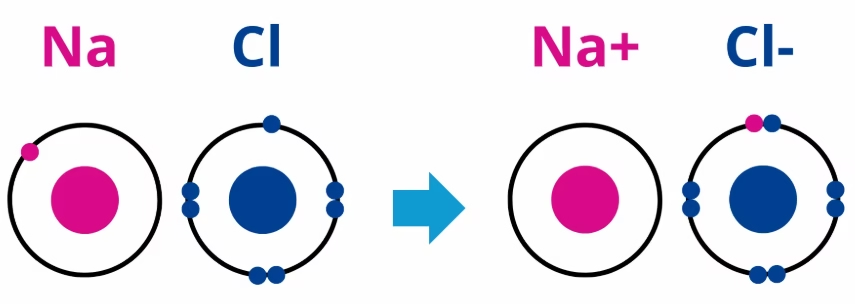
Ejemplo 1: Cloruro de Sodio (NaCl) – Enlace Iónico
- Elementos: Na (sodio) y Cl (cloro).
- Electronegatividades: Na = 0.93, Cl = 3.16.
- Diferencia de Electronegatividad: ΔEN=3.16−0.93=2.23
- Conclusión: Como ΔEN>1.7, el sodio cede un electrón al cloro, formando un enlace iónico.
Ejemplo 2: Agua (H2O) – Enlace Covalente Polar
- Elementos: H (hidrógeno) y O (oxígeno).
- Electronegatividades: H = 2.20, O = 3.44.
- Diferencia de Electronegatividad: ΔEN=3.44−2.20=1.24
- Conclusión: Como 0.4<ΔEN≤1.7, los electrones se comparten desigualmente, haciendo que el agua sea polar.
Ejemplo 3: Dióxido de Carbono (CO2) – Enlace Covalente No Polar
- Elementos: C (carbono) y O (oxígeno).
- Electronegatividades: C = 2.55, O = 3.44.
- Diferencia de Electronegatividad: ΔEN=3.44−2.55=0.89
- Conclusión: Aunque el enlace C=O es polar, la geometría del CO2 es lineal y simétrica, cancelando las cargas parciales, por lo que es covalente no polar en su conjunto.
Ejemplo 4: Metales (Cobre, Oro, Hierro) – Enlace Metálico
- Características:
- Los metales tienen baja electronegatividad y tienden a ceder electrones.
- Sus electrones se deslocalizan, formando un mar de electrones que permite conductividad eléctrica y térmica.
- Conclusión: Los metales forman enlaces metálicos, donde los electrones se mueven libremente entre los núcleos positivos.
Actividad Práctica:
- Con plastilina y palillos, los estudiantes construirán modelos representando diferentes tipos de enlaces químicos.
- Se registrarán observaciones sobre la diferencia entre los enlaces en términos de estructura y comportamiento.
Conclusión y Reflexión Final
Esta clase permite a los estudiantes comprender la evolución de los modelos atómicos, explorar la tabla periódica de manera interactiva y construir modelos físicos que representan los enlaces químicos. A través de un enfoque STEM, los estudiantes conectan la teoría con la práctica, desarrollando habilidades analíticas y experimentales esenciales en química.
Para la próxima sesión:
- Investigar cómo los enlaces químicos influyen en las propiedades físicas y químicas de los materiales que usamos diariamente.
- Identificar aplicaciones industriales de los distintos tipos de enlaces.






Un comentario