La Tabla Periódica – Ordenando los Elementos del Universo
La tabla periódica es uno de los inventos más poderosos y elegantes de la ciencia. En una sola imagen, agrupa todos los elementos químicos conocidos y permite predecir su comportamiento, sus propiedades y hasta cómo se relacionan entre sí. ¿Cómo está organizada? ¿Qué nos dice su forma? ¿Por qué es tan importante entenderla? Vamos a descubrirlo.
¿Qué es la tabla periódica?
La tabla periódica es un esquema organizado de todos los elementos químicos, clasificados según sus propiedades atómicas y químicas. Su forma no es aleatoria: tiene una lógica basada en el número atómico, la configuración electrónica y las propiedades periódicas.
Tabla periódica de los elementos
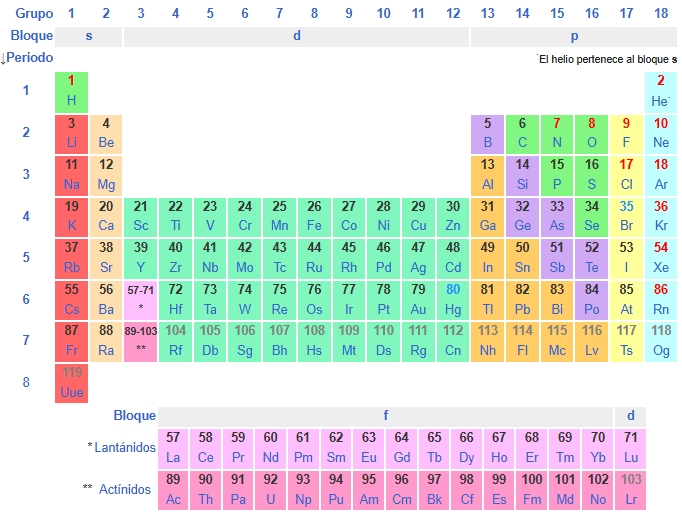
Elementos por categorías

1. Número atómico y disposición
Cada elemento en la tabla tiene un número atómico (Z), que corresponde al número de protones en su núcleo. Los elementos se ordenan de izquierda a derecha y de arriba hacia abajo según este número.
Estado de agregación del elemento a 0°C y 1 atmosfera
2. Períodos: las filas horizontales
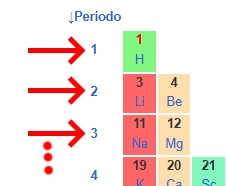
- Hay 8 períodos en total.
- Cada período indica el número de niveles de energía o capas electrónicas que tiene un átomo.
- Por ejemplo, el hidrógeno y el helio están en el período 1 porque tienen un solo nivel de energía.
3. Familias o grupos: las columnas verticales
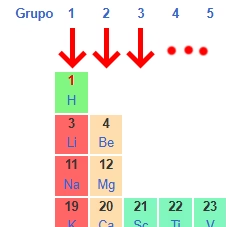
- Hay 18 grupos o familias.
- Los elementos de un mismo grupo tienen la misma cantidad de electrones de valencia, por eso tienen propiedades químicas similares.
- Ejemplos importantes:
| Grupo | Nombre | Características clave |
|---|---|---|
| 1 | Alcalinos | Muy reactivos, metales blandos |
| 2 | Alcalinotérreos | Reactivos, pero menos que los alcalinos |
| 17 | Halógenos | No metales muy reactivos |
| 18 | Gases nobles | Muy estables, no reactivos |
4. Clasificación por tipo de elemento
La tabla periódica no solo organiza a los elementos por número atómico, sino también por su naturaleza química y propiedades compartidas. Esta clasificación es clave para predecir comportamientos químicos, formar compuestos y comprender reacciones, algo que se evalúa frecuentemente en pruebas como el ICFES.
Metales

- Ocupan la mayor parte de la tabla (izquierda y centro).
- Buenos conductores de electricidad y calor.
- Son brillantes, maleables, dúctiles.
- Tienen tendencia a ceder electrones (formando cationes).
- Incluyen subgrupos importantes:
Metales alcalinos (Grupo 1)
- Altamente reactivos, especialmente con el agua.
- Ejemplo: sodio (Na), potasio (K).
- Siempre se encuentran en compuestos, nunca puros en la naturaleza.
Metales alcalinotérreos (Grupo 2)
- Menos reactivos que los alcalinos, pero aún activos.
- Ejemplo: calcio (Ca), magnesio (Mg).
- Importantes en procesos biológicos y estructuras óseas.
Metales de transición (Grupos 3-12)
- Presentan múltiples estados de oxidación.
- Buenos catalizadores, forman compuestos coloreados.
- Ejemplo: hierro (Fe), cobre (Cu), zinc (Zn).
Lantánidos y actínidos
- Elementos de tierras raras, colocados en bloques separados.
- Lantánidos: del 57 al 71. Útiles en tecnología (imanes, láseres).
- Actínidos: del 89 al 103. Algunos son radiactivos (como el uranio).
Otros metales (post-transición)
- Menos reactivos que los de transición.
- Ejemplo: aluminio (Al), plomo (Pb), estaño (Sn).
Metaloides (semimetales)

- Se ubican en la “escalera” diagonal entre los metales y no metales.
- Tienen propiedades intermedias: pueden comportarse como metales o no metales según el contexto.
- Son semiconductores, importantes en la industria tecnológica.
- Ejemplo: boro (B), silicio (Si), arsénico (As).
No metales
- Se encuentran en la zona superior derecha de la tabla.
- Pobre conductividad, frágiles en estado sólido.
- Tienden a ganar electrones para formar aniones.
- Muchos son esenciales para la vida.
- Se dividen en dos grandes grupos:
Otros no metales

- Ejemplo: carbono (C), nitrógeno (N), oxígeno (O), fósforo (P).
- Participan en enlaces covalentes.
- Son versátiles y forman moléculas orgánicas e inorgánicas.
Halógenos (Grupo 17)

- No metales muy reactivos.
- Tienden a formar sales con metales.
- Ejemplo: flúor (F), cloro (Cl), yodo (I).
- Altamente electronegativos.
Gases nobles (Grupo 18)

- Elementos monoatómicos, muy estables.
- No reaccionan fácilmente: tienen su capa de valencia completa.
- Ejemplo: helio (He), neón (Ne), argón (Ar).
- Usados en iluminación, atmósferas controladas y como gases protectores.
¿Por qué es tan poderosa esta organización?
La tabla permite predecir:
- El tipo de enlace que formará un elemento.
- Su estado físico.
- Su capacidad de reacción.
- Su tendencia a perder o ganar electrones.
Además, es fundamental para las ciencias naturales, la medicina, la ingeniería y la vida cotidiana.
Actividad

Dibuja un esquema simplificado de la tabla periódica con al menos:
- Las 7 u 8 filas (períodos)
- Las 18 columnas (grupos)
- Colorea los metales, no metales, y gases nobles con diferentes colores.
- Marca un elemento de cada familia y escribe una propiedad típica.





Un comentario