Tendencias Periódicas
Introducción
La tabla periódica no solo organiza los elementos, ¡también predice cómo se comportan! Las tendencias periódicas nos permiten anticipar el tamaño, la reactividad o la capacidad de atracción de electrones de un elemento con solo ver su posición en la tabla, estas ideas son clave para entender química
1. Radio atómico
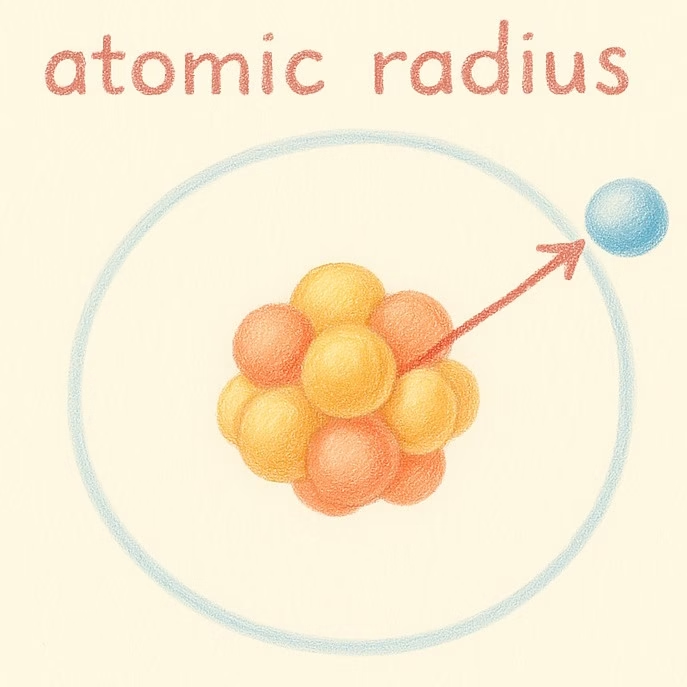
Es la distancia desde el núcleo del átomo hasta el último electrón.
Tendencia:
- Aumenta de arriba hacia abajo en un grupo.
- Disminuye de izquierda a derecha en un período.
Explicación: A medida que bajamos en un grupo, los átomos tienen más niveles de energía, por lo tanto son más grandes. Pero cuando avanzamos en un mismo período, los protones aumentan y atraen con más fuerza a los electrones, reduciendo el tamaño.
2. Energía de ionización
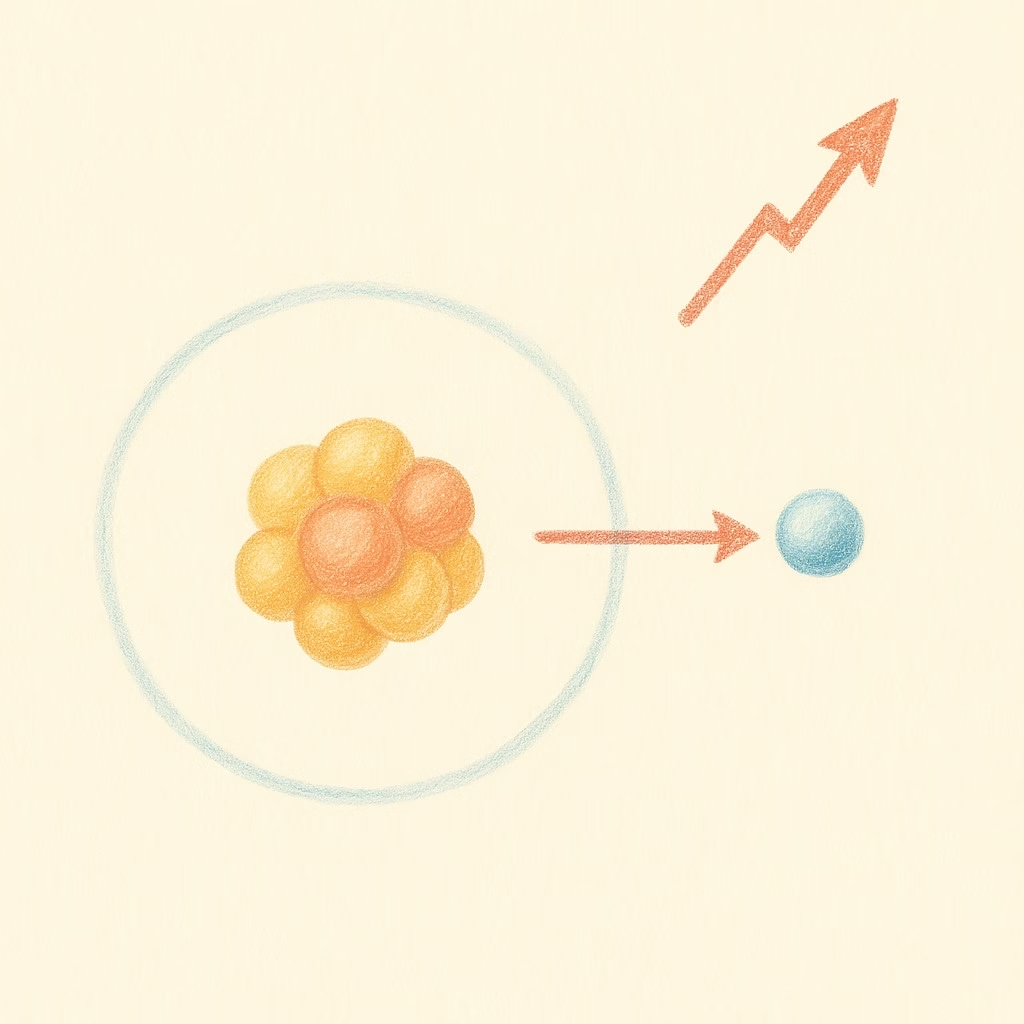
Es la energía necesaria para quitarle un electrón a un átomo neutro.
Tendencia:
- Disminuye de arriba hacia abajo.
- Aumenta de izquierda a derecha.
Ejemplo: Es más fácil quitarle un electrón al sodio que al cloro.
3. Electronegatividad

Es la capacidad de un átomo para atraer electrones cuando forma un enlace químico.
Tendencia:
- Disminuye de arriba hacia abajo.
- Aumenta de izquierda a derecha (excepto gases nobles).
Elemento más electronegativo: Flúor (F).
4. Afinidad electrónica

Es la energía liberada cuando un átomo neutro gana un electrón.
Tendencia:
- Aumenta hacia la derecha en los períodos.
- Disminuye hacia abajo en los grupos.
5. Reactividad química
- Metales: Mayor reactividad al bajar en el grupo (pierden electrones más fácilmente).
- No metales: Mayor reactividad al subir en el grupo (ganan electrones más fácilmente).
Actividad
Realiza la siguiente tabla en el cuaderno:
| Tendencia periódica | ¿Qué mide? | Cómo cambia en un grupo | Cómo cambia en un período |
|---|---|---|---|
| Radio atómico | Tamaño del átomo | Aumenta | Disminuye |
| Energía de ionización | Energía para quitar un electrón | Disminuye | Aumenta |
| Electronegatividad | Capacidad de atraer electrones | Disminuye | Aumenta |
| Afinidad electrónica | Energía al ganar un electrón | Disminuye | Aumenta |
Consulta para el hogar
Instrucciones:
En tu cuaderno (mínimo 10 líneas), responde:
- ¿Por qué el flúor es tan reactivo?
- ¿Qué pasaría si el sodio perdiera un electrón y el cloro lo ganara?
- ¿Qué relación tienen las tendencias periódicas con los enlaces químicos?
Incluye un esquema visual de la tabla periódica con flechas que indiquen cómo cambian las tendencias (puedes guiarte con el material de clase o recursos confiables en línea).
Recuerda: Las tendencias periódicas no son para memorizar sin sentido. Son herramientas científicas para pensar y explicar el mundo químico.





Un comentario